
8月30日,两款PD-1药物获得新进展,分别是誉衡药业/药明生物的赛帕利单抗注射液以及百时美施贵宝的纳武利尤单抗注射液。
图片来源:国家药监局官网
誉衡药业/药明生物
国产第6款PD-1获批上市
国家药监局官网显示,誉衡药业/药明生物研发的重组全人抗PD-1单克隆抗体——赛帕利单抗注射液(GLS-010注射液)获批上市,用于治疗二线以上复发或难治性经典型霍奇金淋巴瘤(r/r cHL)患者。此次获批使该药物成为第6款国产PD-1单抗。
GLS-010注射液是由誉衡生物委托药明生物研发,由北京肿瘤医院牵头及多家国内临床科研机构共同参与完成临床试验申报的首个由转基因动物平台筛选的全人抗PD-1单克隆抗体,具有完善的自主知识产权。
此外,GLS-010注射液在今年3月获得了CDE突破性疗法认定,用于治疗接受过一线或以上含铂标准化疗后进展的复发或转移、PD-L1表达阳性(CPS≥1)宫颈癌的新适应症。
目前国内已上市8款PD-1,其中2款来自进口,其余6款为国内自研,除了新获批的誉衡药业/药明生物产品之外,其他5款分别来自君实生物、信达生物、恒瑞医药、百济神州和康方生物;另外还有两款进口PD-L1。
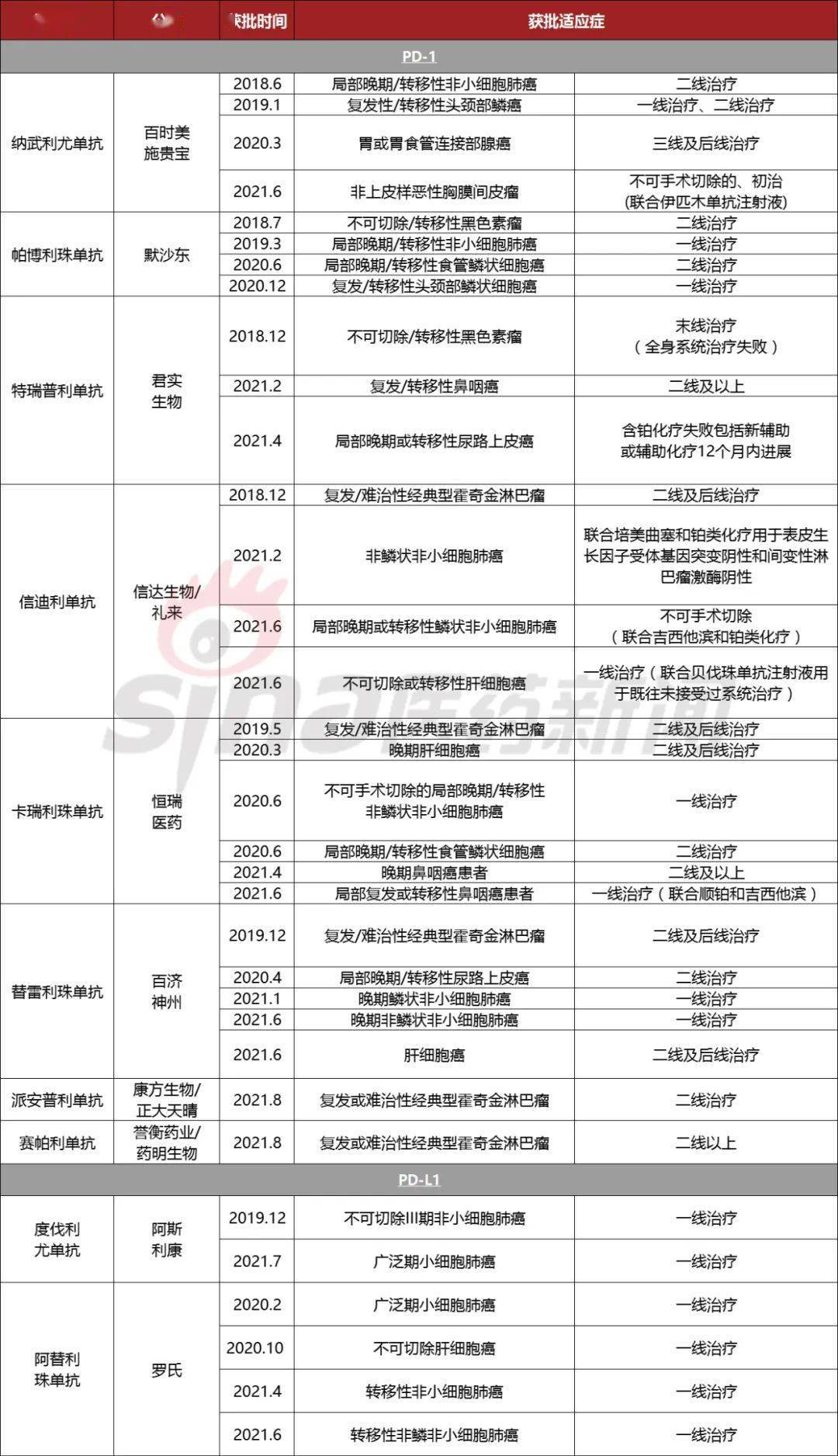
国内已上市PD-1/PD-L1药物
数据来源:国家药监局等
百时美施贵宝PD-1抑制剂
第5项适应症在华获批
国家药监局官网显示,百时美施贵宝PD-1抑制剂纳武利尤单抗注射液(欧狄沃)新适应症获批。据推测,本次获批适应症为晚期或性转移胃癌(GC)、胃食管连接部癌(GEJC)或食管腺癌(EAC)的一线治疗。
纳武利尤单抗是百时美施贵宝开发的一款PD-1抑制剂,该药物利用人体自身的免疫系统来帮助机体恢复抗肿瘤免疫反应,成为多种肿瘤的重要治疗选择。2018年6月15日,纳武利尤单抗在中国首次获批上市。到目前为止,该药已在中国获批四个适应症,除了最新获批的适应症之外,其余四个分别为:
1. 用于治疗表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、既往接受过含铂方案化疗后疾病进展或不可耐受的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者;
2. 用于接受含铂类方案治疗期间或之后出现疾病进展、且肿瘤PD-L1表达阳性(表达PD-L1的肿瘤细胞≥1%)的复发性或转移性头颈部鳞状细胞癌患者;
3. 用于治疗既往接受过两种或两种以上全身性治疗方案的晚期或复发性胃或胃食管连接部腺癌患者;
4. 联合伊匹木单抗注射液用于不可手术切除的、初治的非上皮样恶性胸膜间皮瘤成人患者。
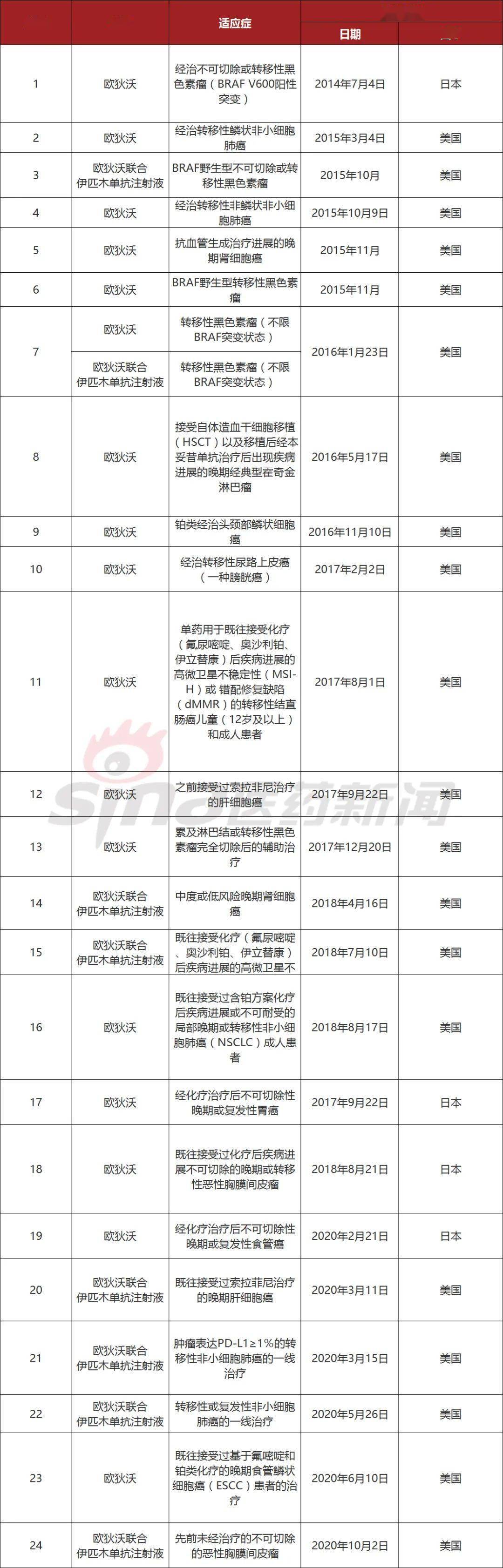
欧狄沃全球获批适应症
数据来源:百度百科
PD-1竞争激烈
作为广谱抗癌产品,近年来PD-(L)1药物在市场上备受追捧。据弗若斯特沙利文分析,2018年全球PD-(L)1抑制剂的市场规模为163亿美元,到2023年预计将达639 亿美元。而在中国,预计2023年PD-(L)1抑制剂的市场规模将达664亿元人民币,2030年则将增长至988亿元人民币。
庞大的市场蓝海下,国内PD-1的研发热潮也开始爆发,据insight数据库数据显示,截至今年3月份,国内已经有85个中国企业研发或合作研发的PD-1产品。目前,嘉和生物的杰诺单抗、复宏汉霖的斯鲁利单抗以及乐普生物普特利单抗已申报上市。此外,基石药业、齐鲁制药、再鼎医药和神州细胞工程的4款 PD-1 已经在3期临床研发中;纳武利尤单抗还有2款生物类似药开始申报临床,来自博安生物和迈博太科。

图片来源:摄图网
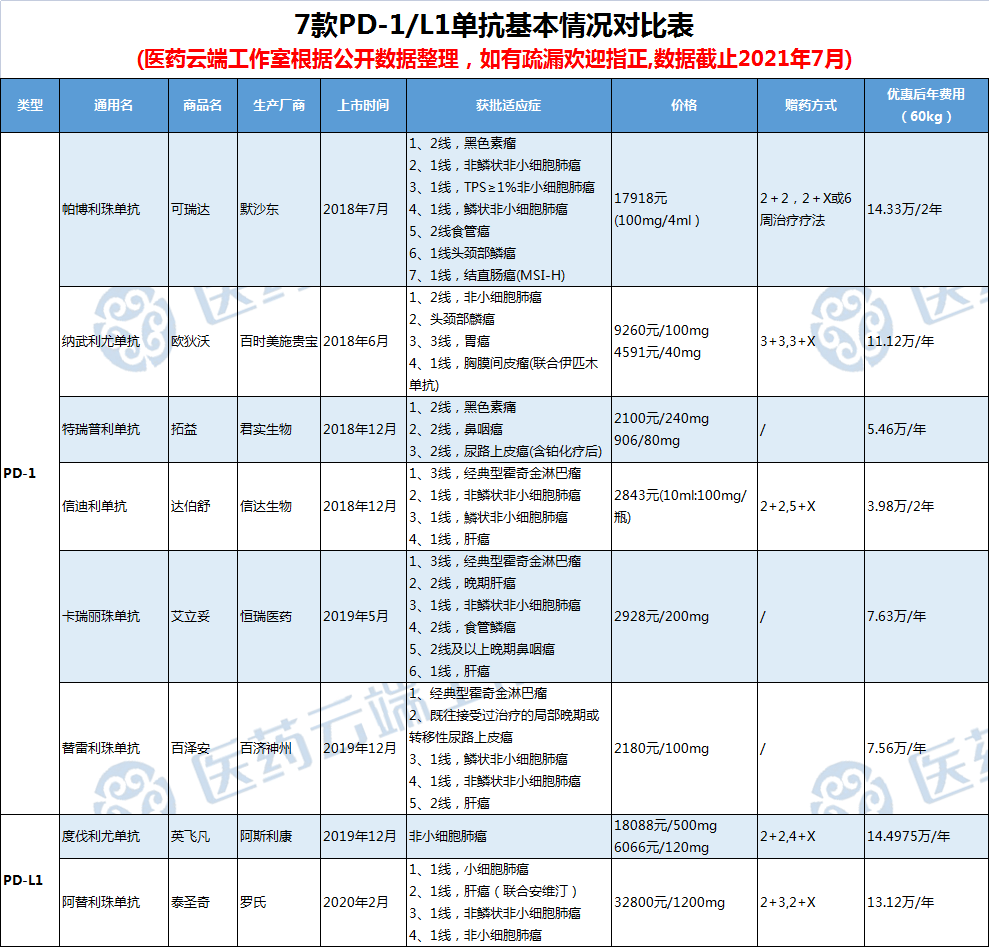
而PD-1价格战也早已打响。2019年国家医保谈判中,信达生物、君实生物、默沙东、施贵宝4家企业角逐,最终信达生物的达伯舒以2843元(10ml:100mg/瓶)的定价成为唯一进入国家乙类医保的PD-1单抗产品,相比其上市时的定价7838元降幅达63.73%。2020年,纳入医保的达伯舒放量,实现销售收入22.9亿元,占当年公司营收近六成。
2020年国家医保谈判中,有7家PD-1/PD-L1企业参与谈判,其中恒瑞医药、百济神州和君实生物的PD-1以平均降价78%的代价全部纳入医保,导致四家外企被拒之门外。从定价来看,尽管国产相对外企普遍具有优势,却也将面临激烈的市场竞争考验。外企在国内市场采取“以价换量”的战略,而这个“地板价”也是国内竞品的“天花板价”。面对如此竞争势头,想要快速抢占市场的话,必须要好好策划一番定价。
*本文转载自新浪医药、医药云端工作室,仅出于传递更多信息之目的,若侵犯了作者的合法权益,我们将及时删除。




